ゲルマニウム(Ge)を飲むと、マクロファージにどのような影響が見られるか。最近浅井Ge研究所で行われた一連の実験結果を、皆さんに供覧します。「Geにより活性化したマクロファージが癌細胞を貪食する」こと。これを皆さんに納得してもらうことを最終的な目標として、お話しますね。

まず、マクロファージとは何か。みなさんご存知ですか。知らないよ、という人は挙手!ああ、何人かおられますね。では説明しましょう。
マクロファージ(macrophage)というのは、ざっくり、白血球の一種です。マクロ経済学、みたいにマクロ(macro)は英語で「大きい」、ファージは、どうもギリシャ語らしいんですが、「食べる」という意味。つまり、マクロファージは、あえて日本語に訳せば、大食細胞(貪食細胞)といったところです。
マクロファージに対する大食漢のイメージは、しかし幾分古いもので、最近の研究によると、マクロファージにはM1型、M2型の2系統あることが言われています。
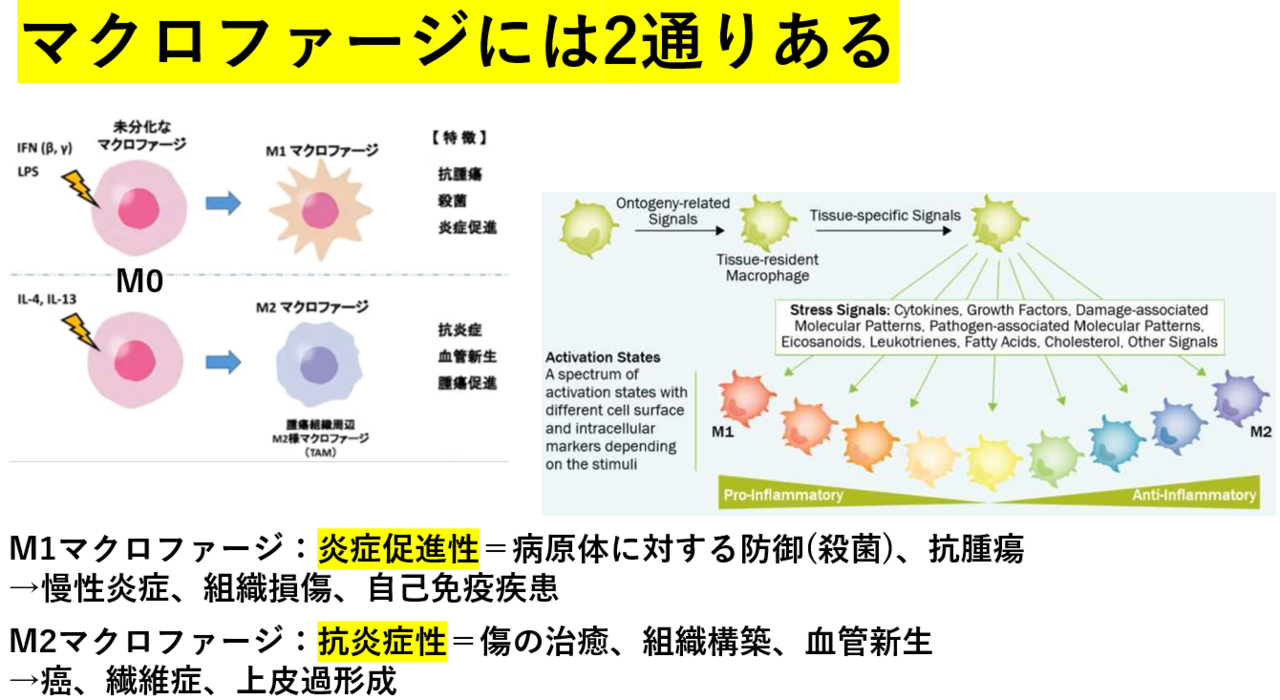
未分化なマクロファージ(M0型)に対して、ある種の刺激(インターフェロン、リポ多糖)が加わるとM1型に、別の刺激(IL4、IL13)が加わるとM2型に分化することが知られています。M1とM2の働きは、真逆です。M1は炎症促進型、つまり病原体の侵入や腫瘍の発生に際して、これらの異物を貪食してその封じ込めを計ります(こちらの方が従来の大食細胞のイメージですね)。一方、M2は抗炎症的な仕事、つまり、創傷の治癒、組織構築に関与します。「破壊と創造」という言葉が対義語として語られますが、M1は破壊、M2は創造を司るという理解でけっこうです。
これらは相反する作用でありながら、いずれも生物にとって必須の作用です。しかし、いずれの作用も、状況次第では病気の原因となり得ます。たとえばM1マクロファーが暴走すると、自分の組織を延々壊し続ける慢性炎症が起こります。たとえばリウマチは、M1マクロファージが関節軟骨を異物と見なして壊し続ける病気です。また、癌はM2マクロファージの暴走です。癌という異物に対して、排斥するどころか、血管新生してまで栄養を送り続けるという異常行動を起こしてしまう。それが癌です。
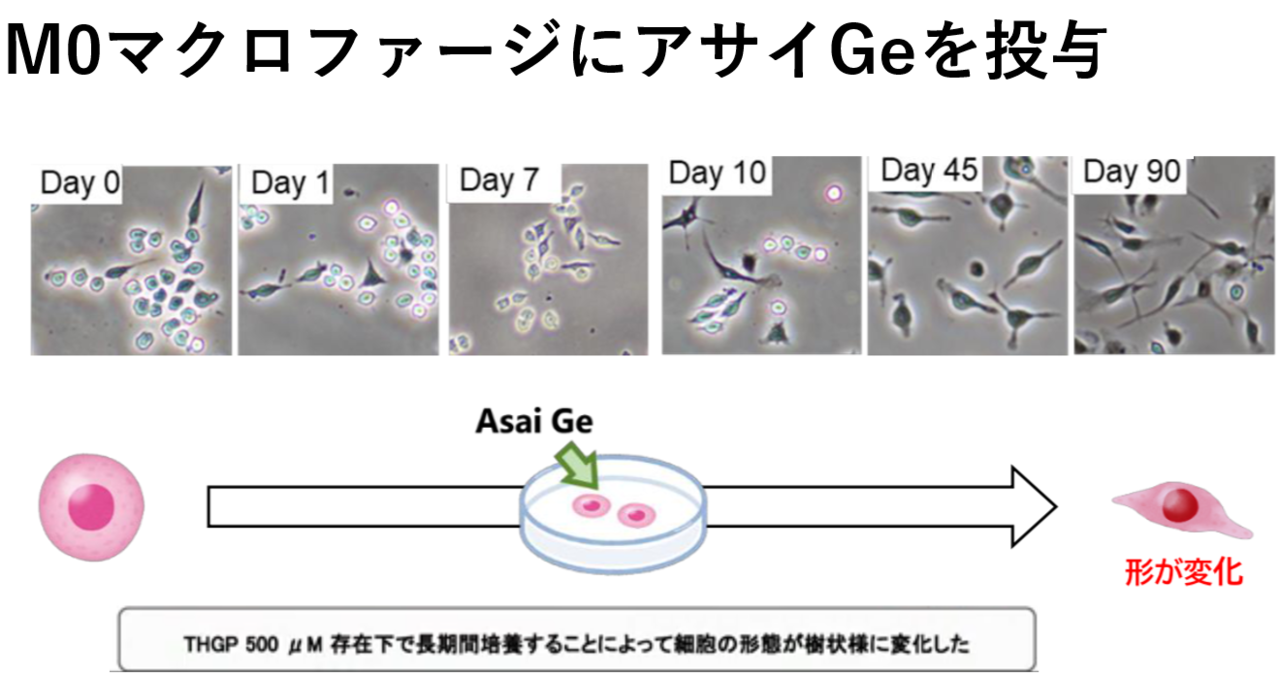
さて、シャーレに未分化なマクロファージ(M0型)とアサイGe(500μM)を入れ長期間(90日)培養すると細長い樹状様の形態に変化した。
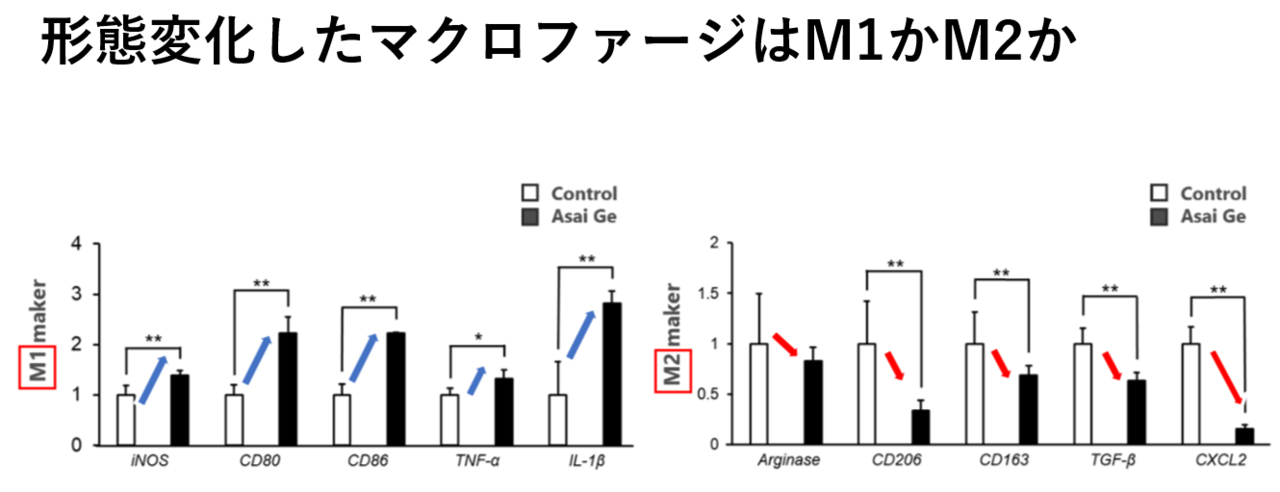
さて、このように成熟したマクロファージはM1かM2か?リアルタイムRT-PCR法で分析したところ、M1関連マーカー(腫瘍抑制に関与するマーカー)が軒並み増加している。一方、M2関連マーカー(腫瘍促進に関与するマーカー)が全て減少している。つまり、M1型が増加し、M2型が減少している。これらの事実から、アサイGeを添加して培養するとM0マクロファージは抗腫瘍活性を持つM1型マクロファージに分化していることが分かりました。
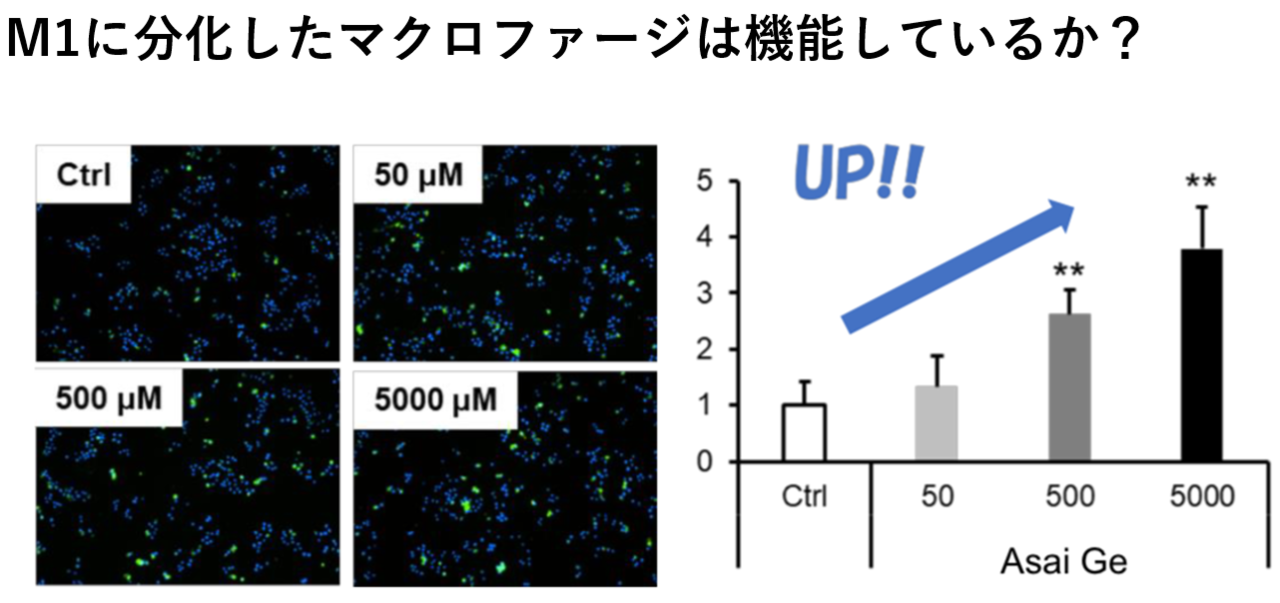
さて、M1型に分化していることを認めるとしても、このマクロファージはきちんと機能するだろうか?数だけ増えても、働きが伴っていないようでは意味がない。そこで、Rabbit IgG FITC-latex beadsというキットを使って、外敵に対する貪食能を調べた。これは小さい光るビーズ玉みたいなもので、マクロファージが貪食すればするほど光る仕組みになっている。つまり、緑の蛍光色で貪食能の強弱を評価できる。
この結果、アサイGeの濃度依存性に(濃ければ濃いほど)M1マクロファージの貪食能が高まることが分かった。
オーケー、M1型に貪食能があることは認めよう。しかし最も肝心なのは、癌細胞を食べてくれるかどうか、である。そこで今度は、M1マクロファージの癌細胞貪食能を調べた。
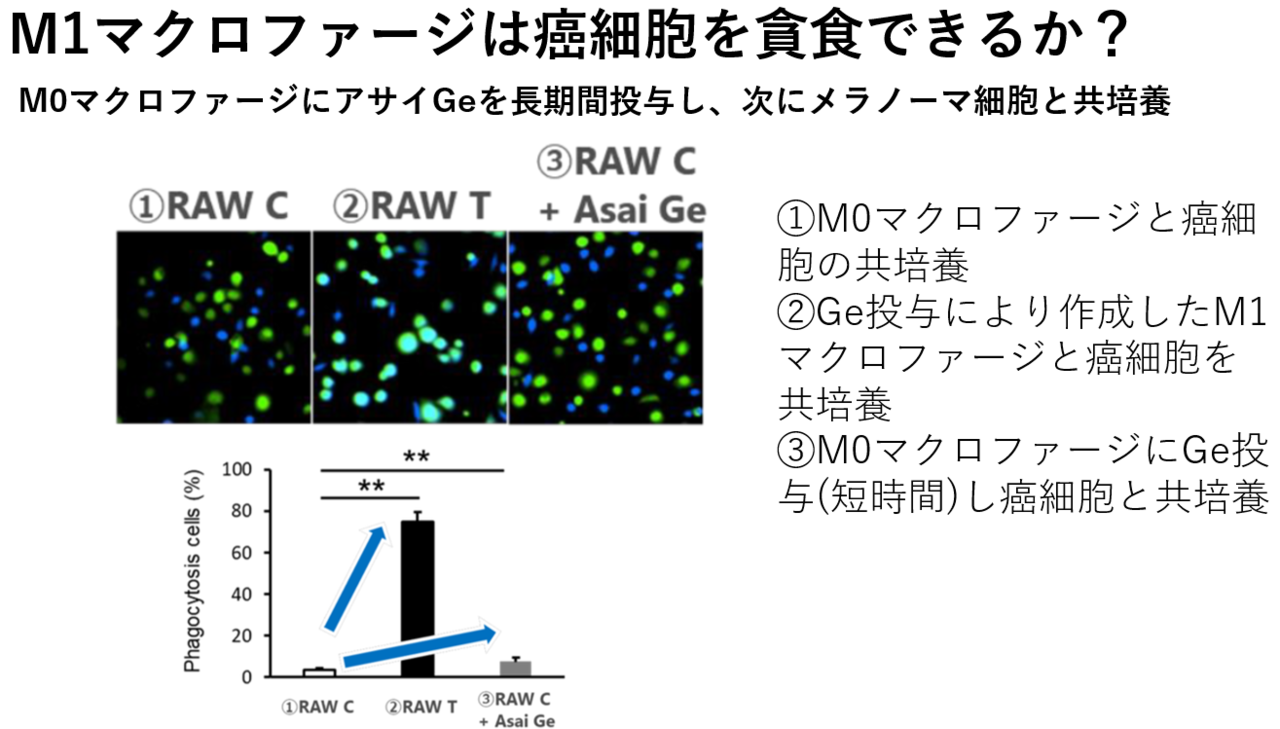
①M0型マクロファージと癌細胞(メラノーマ細胞)を共培養する。
②M0型マクロファージにアサイGeを長期間投与し(当然M1型に分化する)、次にこれと癌(メラノーマ細胞)とを共培養する。
③M0型マクロファージにアサイGeを短時間投与し(M0型のまま)、次に癌細胞と共培養する。
結果は以下のようになった。緑色の発色はM0マクロファージ、青色の発色はメラノーマ細胞、水色の発色はマクロファージによる癌細胞の貪食を示す。
画像を見れば一目瞭然。②でのみ、癌細胞の強い貪食が見られた。結論として、M1型マクロファージは、確かに癌細胞を貪食する。
なるほど、分かった。M1型マクロファージに癌細胞の貪食能があることは認めよう。しかし、その機序は?一体どのようなメカニズムで、M1は癌細胞を認識しているのか?これについて調べてみた。
現在、白血球の癌細胞貪食についての仮説として、”don’t eat me”仮説がある。
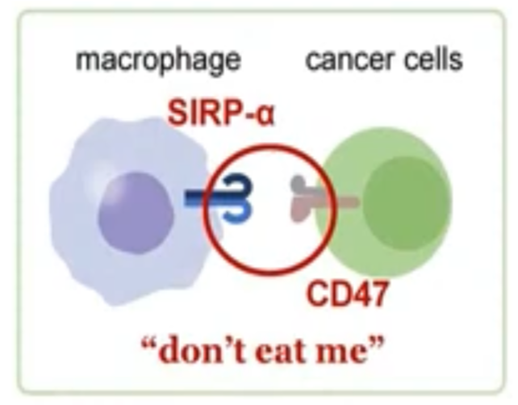
人間誰しも死にたくないように、すべての細胞は生きたいと思っている。癌も例外ではない。癌は細胞表面にCD47というタンパク質を発現している。これが、生体内の大食漢であるマクロファージに対して、”don’t eat me”(「食べないで」)シグナルとして作用する。マクロファージの細胞表面にはSIRPα(Signal Regulatory Protein α)という認識レセプターが発現している。このレセプターがひとたびCD47の発する命乞いメッセージを受け取ってしまうと、マクロファージはこの癌細胞を攻撃できなくなってしまう。
観察事実として、M1型マクロファージは遠慮なくCD47を発現する癌細胞を貪食するが、そのメカニズムを調べるため、以下のような実験を行った。
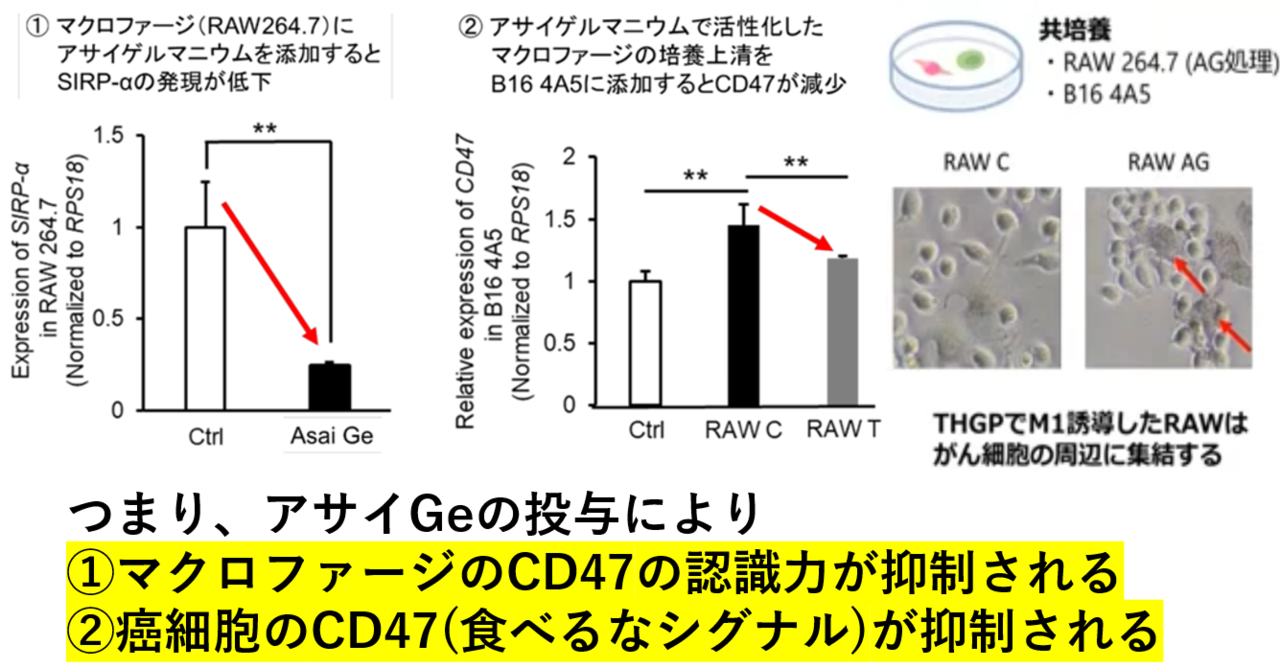
アサイGeを添加して培養したマクロファージのSIRPαについて、Real Time RT-PCR法を使って分析した。①コントロール群に比べ、アサイGe投与マクロファージではSIRPαの発現量が減少していた。また、アサイGeを添加したマクロファージの培養上清を癌細胞に添加すると、癌細胞のCD47発現量が減少した(一方、コントロール群の培養上清を癌細胞に添加するとCD47の発現量が増加した)。
つまり、アサイGeを添加して培養/成熟したM1型マクロファージが癌に対する貪食細胞を発揮する機序は、次の2点である。アサイGeの投与により、
①マクロファージのSIRPαの発現量が低下し、CD47の認識力が抑制される。
②癌細胞のCD47(食べるなシグナル)の発現量が減少する。
アサイGeの抗癌作用の核心には、これら①と②の相乗作用があると考えられる。
さて、どうでしょうか?難しいので、皆さん最後までつい来れなかったかもしれません。大丈夫、安心してください。しゃべっている僕自身、よく理解していませんから(笑)
ただ、僕は、この一連の研究の美しさに感動しました。科学の縮図がここにある、と感じました。仮説を設定し、それを実験により検証する。結果を分析し、ある解釈が導かれる。それを次なる仮説として、さらに検証していく。「そうそう、科学ってこういうことなんだ」と改めて思い出させてくれるように感じました。今日はこの会場に来ていませんが、この研究を行ったのは浅井Ge研究所の30代の若手研究員です。研究所は、少なくともあと20年は安泰だと思います(笑)


